Oxigén reakcióba lép, amit
23. Oxigén és tulajdonságai
Oxigén (O) van a 1 időszakban, VI a csoport a fő alcsoportok. P-elem. Elektronikus konfigurációs 1s22s22p4. Az elektronok száma a külső szint - 6. Oxygen vehet 2 elektront és így ritkán. oxigén vegyértéke 2, az oxidációs állapot -2.
Fizikai tulajdonságok: oxigén (O2) - gáz színtelen, szagtalan és íztelen; enyhén oldódik vízben, kissé nehezebb, mint a levegő. Abban -183 ° C és 101.325 Pa oxigén cseppfolyós, megszerzése, kékes színű. Molekuláris szerkezete: kétatomos oxigén molekula, normál körülmények között a tartós, van mágneses tulajdonságai. Bond a molekulában nem poláris kovalens. Az oxigén allotropic módosítás - az ózon (O3) - erősebb oxidálószer, mint az oxigén.
Kémiai tulajdonságok: befejezése előtt az energia szinten kell 2 oxigén- elektron kap -2 mutatja az oxidáció mértékét, de együtt fluor-oxigén OF2 O2F2 -2 és -1. Mivel a kémiai aktivitása oxigén reagál minden egyszerű anyagok. Fémekkel formában oxidok és peroxidok:
Az oxigént nem csak reagál a platina. A megemelt és a magas hőmérséklet reagálni fog sok nem-fémek:
Az oxigént nem közvetlenül reagáltatjuk halogének. Oxigén reakcióba lép számos összetett anyagok:
Oxigén égési reakció jellemzi:
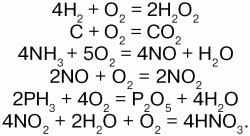
Az oxigén éget sok szerves anyagot:
Az oxidációt az oxigén az acetaldehid, ecetsav kapjuk:
Elkészítés: a laboratóriumban: 1) elektrolízisével vizes lúgoldatot adunk, ahol a képletben hidrogén szabadul fel a katód és az anód - oxigén; 2) bomlása kálium-klorát hevítve: 2KSlO3 2KSl + 3O2?;? 3) igen tiszta oxigén: 2KMnO4 K2MnO4 + MnO2 + O2?.
Mivel a természetben: oxigén 47,2% -a a tömeg a héja. A szabad állapotban lévő levegő - 21%. Része számos természetes ásványi anyagok, hatalmas organizmusok számát megtalálható növények és állatok. A természetes oxigén három izotópok: O (16) O (17) O (18).
Alkalmazás: használt kémiai, kohászati, az orvostudományban.