Oxigén - elem jellemzőket, az előfordulási gyakoriság természetben, fizikai és kémiai tulajdonságai
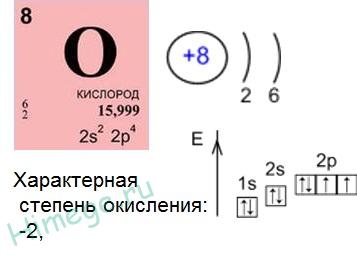
Az oxigénnel oxidálhatunk ismert -2, -1, +1, +2
Általános jellemzők Az elem
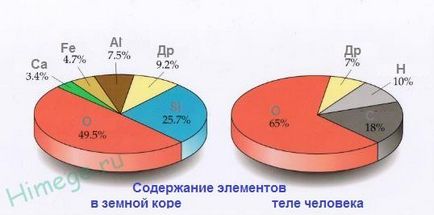
Oxigén - a leggyakoribb elem a Földön, számviteli valamivel kevesebb, mint a fele, 49% -a teljes tömege a Föld kérgében. A természetes oxigén három stabil izotópok 16 O, 17 O és 18 O (16 O túlsúlyban). Oxigén tartalmazza az összetétel az atmoszféra (20,9 térfogat%, 23,2 tömeg) a víz, és több mint 1400 ásványok: kovasav, szilikátok és alumínium-szilikátok, márvány, bazalt, hematit és más ásványok és kőzetek. Az oxigén az 50-85 tömeg% növényi és állati szövetek, tk szereplő fehérjék, zsírok és szénhidrátok, alkotó élő szervezetek. Jól ismert szerepét oxigén légzés, az oxidációs folyamatok.
Oxigén viszonylag kevés oldódik vízben - 5 térfogat 100 térfogatrész vízzel. Azonban, ha az összes oldott oxigén a vízben vezetjük a légkörbe, akkor vesz egy hatalmas összeg - 10 millió km 3 (STP). Ez egyenlő mintegy 1% oxigén a légkörben. Oktatás a Föld légkörében az oxigénből a fotoszintézis során.
Nyisd Swede K. Scheele (1771 - 1772 yy), és az angol J. Priestley (1774) ... Az első használt nitrát fűtési, a második - higany-oxid (2). Ő adta a nevét Lavoisier ( „oksigenium” - „a szülést, hogy a sav”).
A szabad állapotban létezik két allotropic módosítások - a „rendes” oxigén O2 és az ózon O3.
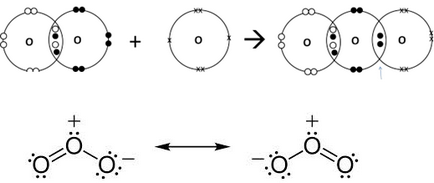
A szerkezet a ózon molekula
3O2 2O3 = - 285 kJ
A ózon a sztratoszféra vékony réteget alkot, amely elnyeli a legtöbb biológiailag káros ultraibolya sugárzás.
Amikor a tároló az ózon az oxigén válik spontán. A kémiailag oxigén O2 kevésbé aktív, mint az ózon. oxigén Elektronegativitás 3.5.
Fizikai tulajdonságok oxigén
O2 - gáz színtelen, szagtalan és íztelen, op -218,7 ° C, fp. -182,96 ° C, a paramágneses.
O2 kék folyadék, szilárd anyag - kék. O2 oldódik vízben (jobb, mint a nitrogén és hidrogén).
Első oxigén
1. Ipari eljárás - desztillálásával cseppfolyós levegő és a víz elektrolízis:
2. Az oxigén laboratóriumban elkészített:
1.Elektrolizom lúgos vizes oldatok vagy vizes oldatok oxigén-tartalmú sók (Na 2SO 4, stb).
2. A hőbomlás kálium-permanganát KMnO4:
2KMnO4 = K2 MnO4 + MnO2 + O2 ↑,
Kálium-klorát KClO3:
2KClO3 = 2KCl + 3O2 ↑ (MnO2 katalizátor)
Ha a kevert K2 O2 és K2 O4 ekvimoláris (azaz ekvimoláris) mennyiségben, 1 mól CO2 abszorbeált egy mól O2 van kiemelve.
Kémiai tulajdonságok oxigén
Oxigén vegyérték héj található, a 2. szint - viszonylag közel van a mag. Ezért, a lényege erősen vonzza az elektronokat. A vegyérték-héj oxigén 2s 2 2p 4 6 elektronok. Következésképpen, a oktett hiányzik két elektron, amely hajlamos arra, hogy az oxigént a elektronhéjak más elemek azáltal, hogy azokat a reakcióban oxidálószerként.
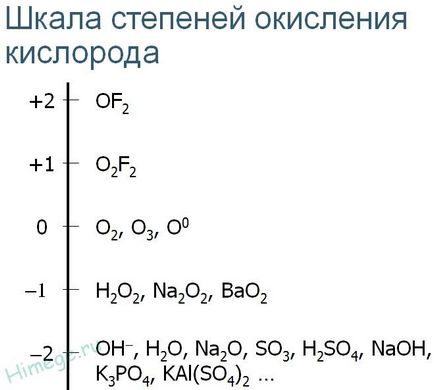
Tehát az oxigén - második legerősebb oxidáló között minden eleme a periódusos rendszer. Ehhez kapcsolódik, hogy a legtöbb a legfontosabb kémiai tulajdonságait.
Az oxigén reagálnak eltekintve minden elem Au, Pt, He, Ne, Ar, az összes reakciót (kivéve a kölcsönhatás fluoratom), oxigén - oxidálószer.

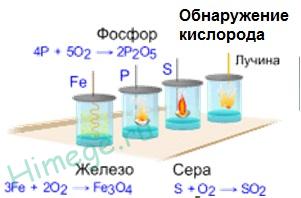
Finom vaspor (ún piroforos vas) spontán begyullad, levegőn, Fe2 O3. és acél ég oxigén, ha előzetesen hő:
A nemfémes elemek (. Kén, grafit, hidrogénatom, foszfor, stb), az oxigén reakcióba lép a fűtés:
Szinte az összes műveleteket, ahol oxigént O2 exoterm, néhány kivételtől eltekintve, például:
Ez a reakció feletti hőmérsékleten 1200 ° C, vagy elektromos kisülés.
Az oxigén képes oxidálni a komplex anyag, például:
2H2 S + O2 → 2S + 2H2 O (oxigénhiány)
4NH3 + 5O2 → 4NO + 6H2 O (jelenlétében Pt katalizátor)
Ismert tartalmazó vegyületek kation dioksigenila O2 +. így például, O2 + [PtF6] - (sikeres E vegyület szintézisének vezetett N. Bartlett próbálja vegyületek előállítására inert gázok).

Ózon kémiailag aktívabb, mint az oxigén O2. Így, az ózon oxidálja jodid - ionok I - Kl oldatban:
Ózon rendkívül mérgező, a mérgező tulajdonságai erősebb, mint, például a hidrogén-szulfid. Jellege azonban az ózon szereplő magas rétegeiben a légkör, szerepet tölt be a védő minden földi élet a káros ultraibolya sugárzás a nap. Vékony ózonréteg elnyeli ezt a sugárzást, és nem éri el a föld felszínét. Vannak jelentős eltérések a vastagsága és hossza a réteg idővel (ún ózonlyuk) okoz az ilyen típusú oszcillációk még nem tisztázott.
Az oxigén alkalmazása O2. intenzívebbé a termelés a nyersvas és acél, színesfém a olvasztása, oxidáló szerként különböző kémiai eljárásokkal, életfenntartó víz alatti hajók, oxidálószerként hajtógáz (folyékony oxigén) a gyógyászatban, hegesztés és vágás fémek.
Az ózon alkalmazását O3: fertőtlenítésére ivóvíz, szennyvíz, levegő, a textília fehérítésére.